Ион и атом: что общего и в чем разница
Ион и атом: что общего и в чем разница

Ион – неэлементарная частица, несущая положительный или отрицательный заряд. Ион получается в процессе отрыва или присоединения электрона к атому или группе атомов. Ион с отрицательным зарядом (атом с избытком электронов) называется анионом, а ион, несущий положительный заряд, (атом с недостатком электронов) – катионом.

Как происходит образование ионов
Ион образуется из атома в процессе, называемом ионизацией. Катион образуется, когда электрон в атоме получает энергию ионизации, дающую ему возможность преодолеть потенциальный барьер, и удалится от атома, преодолев силы электростатического притяжения. Процесс образования аниона происходит с выделением энергии, когда атом получает дополнительный электрон.
Ионизация может наступить из-за повышения температуры, воздействия электрического поля, рентгеновского излучения или освещения.

Ионизация газов
Все щелочные металлы (рубий, натрий, калий, литий, цезий, франций) являются хорошими восстановителями, то есть легко отдают электроны другим атомам, превращаясь в положительно заряженные ионы. Происходит это за счет невысокой энергии ионизации – до 5 эВ. Франций — самый сильный восстановитель. Атомы этого элемента отдают электроны легче, чем другие, за счет очень низкой энергии ионизации. Щелочные металлы имеют всего один валентный электрон, и его легче отдать, чем присоединить семь электронов для завершения энергетического уровня. Щелочные металлы могут превращаться в положительно заряженные ионы просто под воздействием освещения.
Аналогичным свойством обладает водород. Его атом имеет единственный электрон и легко отдает его, образуя катион.
Галогены – фтор, бром, йод, хлор и астат (элементы, находящиеся в основной подгруппе 7-ой группы таблицы Менделеева) обладают высокой электроотрицательностью – свойством смещать к себе общие пары электронов в соединении. Они легко образуют анионы, поскольку на внешнем уровне у них уже 7 электронов, и недостает всего одного для завершения уровня. Бром, хлор, йод и астат могут образовывать как отрицательные, так и положительные ионы при контакте с более электроотрицательными элементами. Фтор никогда не образует положительных ионов, так как является элементом с самой высокой электроотрицательностью и имеет высокую энергию ионизации.
Что же общего у атома и иона?
Атом и ион одного и того же элемента имеют в ядре одинаковое количество протонов и нейтронов.
Ион обозначается тем же символом, что и соответствующий химический элемент в периодической таблице, только справа указывается значение заряда.
Отличия между атомом и ионом
Основное отличие между атомом и ионом в том, что ион – заряженная частица, а атом – не заряженная.
Также атом и ион одного и того же элемента отличаются по массе, за счет разницы в количестве электронов. Катион имеет меньшую массу, чем атом того же элемента, а анион, соответственно, большую. Разница между массой атома и массой иона кратна массе электрона.
Ионы, в отличии от атомов, не обладают свойствами простого вещества. Примером этого могут служить кристаллы йода, которые имеют темно-синий цвет, в газообразном состоянии он фиолетовый, а его ионы бесцветны. Ионы йода не дают цветной реакции с крахмалом и не ядовиты, в отличии от кристаллов.
Аналогичный пример – медь. Этот металл имеет золотисто-красный цвет, а его ионы – зелено-голубые.
Калий – серебристый металл, атомы которого активно реагирую с водой, в то время как ионы этого вещества не обладают таким свойством. То же самое различие характерно для свойств атомов и ионов натрия.
Катион водорода в реакции с аммиаком формирует ион аммония. Для молекулы водорода такая реакция не характерна.
Ионы имеют завершенный внешний энергетический уровень – на нем 8 электронов. Никакие атомы, кроме инертных газов, не обладают этим свойством.
Разница между атомом и ионом
Атомы являются строительными блоками материи. Вся материя состоит из атомов. Ранее ученые полагали, что атом не может быть далее разделен. Но более поздние открытия обнаружили, что атомы могут быть д

Содержание:
- Главное отличие — Атом против Иона
- Что такое атом
- Что такое ион
- Сходство между атомом и ионом
- Разница между атомом и ионом
Главное отличие — Атом против Иона
Атомы являются строительными блоками материи. Вся материя состоит из атомов. Ранее ученые полагали, что атом не может быть далее разделен. Но более поздние открытия обнаружили, что атомы могут быть далее разделены на субатомные частицы. Основными субатомными частицами являются протоны, нейтроны и электроны. Базовая структура, состоящая из нескольких атомов, называется молекулой. Ион является производным определенного атома. Основное различие между атомом и ионом состоит в том, что атомы не имеют суммарного электрического заряда, тогда как ионы имеют суммарный электрический заряд.
Ключевые области покрыты
1. Что такое атом
— Определение, основные характеристики и примеры
2. Что такое ион
— Определение, основные характеристики и примеры
3. Каковы сходства между атомом и ионом
— Краткое описание общих черт
4. В чем разница между атомом и ионом
— Сравнение основных различий
Ключевые слова: анион, атом, катион, электрон, ион, нейтрон, протон

Что такое атом
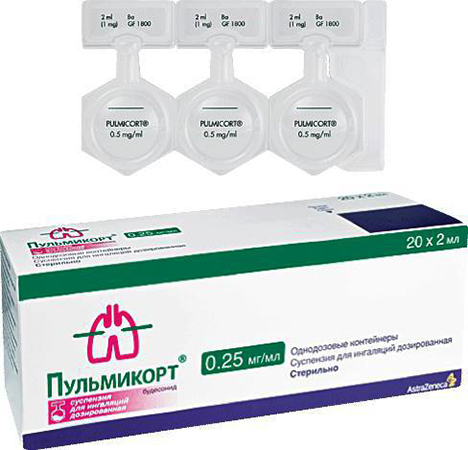
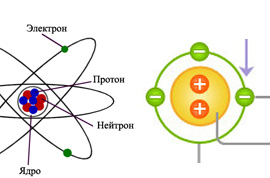
Атом является фундаментальной единицей всей материи. Другими словами, вся материя состоит из атомов. Хотя ученые ранее полагали, что атомы не могут быть далее разделены, эта концепция больше не действует. Эта концепция была изменена с открытием электрона, протона и ядра. После этого была разработана атомная теория, в которой описана структура атома.
Согласно современной атомной теории, атом состоит из двух компонентов. Это ядро и атомные орбитали. Ядро состоит из протонов, которые являются положительно заряженными субатомными частицами, и нейтронов, которые являются нейтрально заряженными субатомными частицами. Заряд протона +1. Вокруг ядра находится электронное облако, в котором электроны атома движутся вдоль гипотетических орбиталей. Электрон имеет электрический заряд -1. Следовательно, электроны являются отрицательно заряженными частицами.
Атомы определенного элемента идентичны друг другу. Поэтому число протонов и нейтронов, присутствующих в ядре атомов, одинаково для одного элемента. Количество электронов вокруг ядра одинаково для атомов, принадлежащих одному элементу.
Протоны и нейтроны слипаются в ядре благодаря сильным силам, которые существуют между этими частицами. Эти силы называются взаимодействиями. Эти взаимодействия происходят из-за обмена очень маленькими частицами, называемыми мезоны, Поэтому, чтобы разложить ядро на протоны и нейтроны, требуется очень высокая энергия. Электроны движутся вокруг ядра. Поскольку электроны заряжены отрицательно; электроны не притягиваются к положительно заряженным протонам в ядре, не попадают на ядро, так как сила, которая накапливается в результате движения электрона, равна силе притяжения ядра. Поскольку эти две силы уравновешивают друг друга, электроны остаются в своем движении на определенном расстоянии от ядра. Путь, по которому движутся эти электроны, называется оболочкой или орбитой.

Рисунок 1: Упрощенная структура атома
Структура атома может быть дана так, но это неверно. Фактическая структура намного сложнее, чем на изображении выше.
Атомы могут принимать участие в химических связях. Атомы соединяются вместе, образуя молекулы или соединения. Эти вложения происходят через химические связи. Эти связи могут быть ковалентными связями, ионными связями, координационными связями или металлическими связями. При образовании этих связей происходит обмен электронами. Но протоны и нейтроны в ядре не участвуют в химической связи. Но в процессе радиоактивного распада ядро атома превращается в совершенно другое ядро путем преобразования протонов или нейтронов в разные частицы вместе с излучением излучения.
Что такое ион
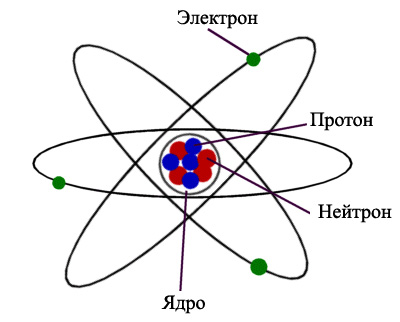
Ион — это атом или молекула, которая имеет чистый электрический заряд. Этот заряд может быть положительным или отрицательным. Ион образуется, когда атом или молекула теряют или приобретают электроны. Например, если конкретный атом теряет электрон, то электронов недостаточно, чтобы нейтрализовать полный положительный заряд ядра. Поэтому весь атом получает чистый положительный заряд. Но если атом получает электрон, то в ядре недостаточно протонов, чтобы нейтрализовать общий отрицательный заряд всех электронов. Поэтому весь атом получает чистый отрицательный заряд. Поскольку ионы представляют собой электрически заряженные частицы, они могут притягиваться электрическим полем. Отрицательные ионы притягиваются к положительному полюсу, тогда как положительно заряженные ионы притягиваются к отрицательному полюсу.
Ионы могут образовывать ионные связи. Ионная связь представляет собой тип химической связи, которая возникает из-за электростатического притяжения между двумя ионами, которые заряжены противоположно. Отрицательный ион образует ионные связи с одним или несколькими положительными ионами, чтобы нейтрализовать суммарный электрический заряд.

Рисунок 2: Образование катионов и анионов
Ионы встречаются в двух типах; катионы и анионы. Катионы — это атомы или молекулы, имеющие чистый положительный заряд, тогда как анионы — это атомы или молекулы, имеющие чистый отрицательный заряд. Анионы и катионы притягиваются друг к другу, так как они являются противоположно заряженными видами.
Если ион представляет собой один атом, то это одноатомный ион. Если ион — это молекула, то это многоатомный ион. Атомы металлов часто образуют положительно заряженные ионы или катионы, удаляя один или несколько электронов с самой внешней орбитали. Это потому, что атомы металла состоят из меньшего числа электронов на их самой внешней орбитали и слабо связаны с ядром. Следовательно, эти электроны могут быть легко потеряны, образуя катион, чем образуя анион, получив большое количество электронов для заполнения орбитали. Большинство неметаллов имеют тенденцию делиться своими неспаренными электронами, а не терять или приобретать их. Но если они стремятся стать ионами, они получают электроны, образующие анион, а не превращаются в катион, удаляя большое количество электронов.
Сходство между атомом и ионом
- Атомы могут стать ионами.
- И атомы, и ионы состоят из электронов, которые можно обменять.
Разница между атомом и ионом
Определение
Атом: Атом является фундаментальной единицей всей материи.
Ion: Ион — это атом или молекула, которая имеет чистый электрический заряд.
Электрический заряд
Атом: Атомы заряжены нейтрально.
Ion:Ионы заряжены либо положительно, либо отрицательно.
Аттракцион к электрическому полю
Атом: Атомы не притягиваются к электрическому полю.
Ion:Ионы притягиваются к электрическим полям в соответствии с их электрическим зарядом.
Количество электронов
Атом: Атомы состоят из равного числа электронов и протонов.
Ion:Ионы состоят из неодинакового числа электронов и протонов.
Заключение
Атомы являются фундаментальной единицей всей материи, из которой состоит вся материя. Атомы могут стать ионами, получая или удаляя электроны. Но не все ионы являются атомами, потому что есть молекулы, которые могут стать ионами, удаляя или получая электроны этой молекулой. Основное различие между атомом и ионом состоит в том, что атомы не имеют суммарного электрического заряда, тогда как ионы составляют суммарный электрический заряд.
Рекомендации:
1. Хельменстин, Энн Мари. «Что такое атом? (Пояснения и примеры). ”ThoughtCo. Н.п., н.д. Web.
Ион и атом: что общего и в чем разница
Атомы и ионы – микроскопические частицы, которые состоят из ядра и электронов, вращающихся вокруг него по орбиталям. Основное, но не единственное, отличие между этими частицами состоит в том, что ион несет определенный заряд, а атом – нет.
Общие сведения об атомах и ионах
Атом – наименьшая частица вещества, обладающая всеми его свойствами. Радиус атома измеряется в пикометрах (метра). Атом – электронейтральная, то есть не несущая заряда структура, состоящая из ядра и вращающихся вокруг него электронов. Ядро атома состоит из протонов и нейтронов, которые также называются субатомными частицами. Протон несет положительный заряд, по модулю равный заряду электрона. Нейтроны не имеют заряда. Количество электронов в атоме соответствует числу протонов в ядре, что делает атом в целом электронейтральным.
Ион – неэлементарная частица, несущая положительный или отрицательный заряд. Ион получается в процессе отрыва или присоединения электрона к атому или группе атомов. Ион с отрицательным зарядом (атом с избытком электронов) называется анионом, а ион, несущий положительный заряд, (атом с недостатком электронов) – катионом.
Как происходит образование ионов
Ион образуется из атома в процессе, называемом ионизацией. Катион образуется, когда электрон в атоме получает энергию ионизации, дающую ему возможность преодолеть потенциальный барьер, и удалится от атома, преодолев силы электростатического притяжения. Процесс образования аниона происходит с выделением энергии, когда атом получает дополнительный электрон.
Ионизация может наступить из-за повышения температуры, воздействия электрического поля, рентгеновского излучения или освещения.
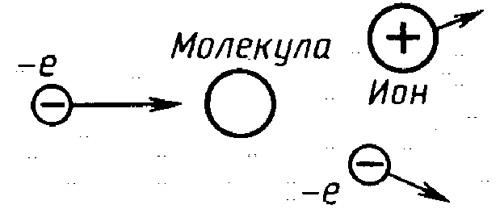
Все щелочные металлы (рубий, натрий, калий, литий, цезий, франций) являются хорошими восстановителями, то есть легко отдают электроны другим атомам, превращаясь в положительно заряженные ионы. Происходит это за счет невысокой энергии ионизации – до 5 эВ. Франций — самый сильный восстановитель. Атомы этого элемента отдают электроны легче, чем другие, за счет очень низкой энергии ионизации. Щелочные металлы имеют всего один валентный электрон, и его легче отдать, чем присоединить семь электронов для завершения энергетического уровня. Щелочные металлы могут превращаться в положительно заряженные ионы просто под воздействием освещения.
Аналогичным свойством обладает водород. Его атом имеет единственный электрон и легко отдает его, образуя катион.
Галогены – фтор, бром, йод, хлор и астат (элементы, находящиеся в основной подгруппе 7-ой группы таблицы Менделеева) обладают высокой электроотрицательностью – свойством смещать к себе общие пары электронов в соединении. Они легко образуют анионы, поскольку на внешнем уровне у них уже 7 электронов, и недостает всего одного для завершения уровня. Бром, хлор, йод и астат могут образовывать как отрицательные, так и положительные ионы при контакте с более электроотрицательными элементами. Фтор никогда не образует положительных ионов, так как является элементом с самой высокой электроотрицательностью и имеет высокую энергию ионизации.
Что же общего у атома и иона?
Атом и ион одного и того же элемента имеют в ядре одинаковое количество протонов и нейтронов.
Ион обозначается тем же символом, что и соответствующий химический элемент в периодической таблице, только справа указывается значение заряда.
Отличия между атомом и ионом
Основное отличие между атомом и ионом в том, что ион – заряженная частица, а атом – не заряженная.
Также атом и ион одного и того же элемента отличаются по массе, за счет разницы в количестве электронов. Катион имеет меньшую массу, чем атом того же элемента, а анион, соответственно, большую. Разница между массой атома и массой иона кратна массе электрона.
Ионы, в отличии от атомов, не обладают свойствами простого вещества. Примером этого могут служить кристаллы йода, которые имеют темно-синий цвет, в газообразном состоянии он фиолетовый, а его ионы бесцветны. Ионы йода не дают цветной реакции с крахмалом и не ядовиты, в отличии от кристаллов.
Аналогичный пример – медь. Этот металл имеет золотисто-красный цвет, а его ионы – зелено-голубые.
Калий – серебристый металл, атомы которого активно реагирую с водой, в то время как ионы этого вещества не обладают таким свойством. То же самое различие характерно для свойств атомов и ионов натрия.
Катион водорода в реакции с аммиаком формирует ион аммония. Для молекулы водорода такая реакция не характерна.
Ионы имеют завершенный внешний энергетический уровень – на нем 8 электронов. Никакие атомы, кроме инертных газов, не обладают этим свойством.
Атомы, ионы, молекулы
Атом и его строение
Над тем, как устроено вещество, люди размышляли с глубокой древности. Античные греческие ученые предполагали, что вещества состоят из мельчайших, невидимых глазу частиц разной формы, которые соединяются друг с другом при помощи различных крючков и присосок. Слово «атом» в переводе с греческого означает «неделимый». Так ли это? Действительно ли атом неделим? Существование атома было доказано лишь в XIX веке путем эксперимента. Установлено, что атом содержит еще более мелкие по размеру частицы. Атом состоит из ядра и электронов, находящихся в околоядерном пространстве. В ядре сосредоточена практически вся масса атома. Вклад электронов в массу атома крайне мал. Масса электрона составляет 9,1 · 10−31 кг.
Каждый электрон заряжен отрицательно, условно его заряд принимают равным –1. Символ, которым принято обозначать электрон – ē. Электроны движутся вокруг ядра, перемещаясь по сложным траекториям. Ядро атома состоит из двух типов частиц: протонов и нейтронов. Протоны обозначают буквой р, а нейтроны – n.
В целом атом электронейтрален, то есть его заряд равен нулю. С учетом электронейтральности атома, количество электронов в атоме всегда совпадает с количеством протонов. С учетом того, что в ядре только протоны заряжены (нейтроны заряда не имеют), и заряд каждого протона +1, ядро имеет заряд. Заряд ядра определяется количеством протонов, и всегда имеет знак + Заряд ядра обозначают символом Z (протонное число) Как определить количество электронов и протонов в атоме? На приведена схема строения атома водорода. Видно, что атом водорода состоит из одного отрицательно заряженного электрона и положительно заряженного ядра, состоящего из одного протона.
Количество электронов и протонов в атоме химического элемента совпадает с его порядковым номером Рассмотрим другой пример. Определим количество электронов, протонов и заряд ядра для атома кислорода. Порядковый номер кислорода – 8.
Значит, в его атоме содержится 8 электронов, 8 протонов, заряд ядра +8. Как определить количество нейтронов?
В начале параграфа уже упоминалось, что практически вся масса атома сосредоточена в его ядре. В свою очередь ядро состоит из протонов и нейтронов. Относительная атомная масса элемента, записанная в Периодической Системе, приблизительно равна сумма масс протонов и нейтронов, поскольку масса электронов очень мала. Сумму масс протонов и нейтронов, равную округленной атомной массе химического элемента, называют массовым (нуклонным) числом и обозначают А. Определим количество нейтронов в атоме кислорода.
Относительная атомная масса кислорода с учетом округления равна 16. Вычтем количество протонов: 16 – 8 = 8. В атоме кислорода 8 нейтронов.
С учетом вышесказанного можем записать несколько простых выражений:
- количество электронов равно количеству протонов ē = p;
- заряд ядра равен количеству протонов и имеет знак +, Z = p
Атом – мельчайшая частица вещества, состоящая из ядра и электронов, движущихся в околоядерном пространстве Протоны и нейтроны имеют общее название – нуклоны (от лат. nucleus – «ядро»).
Термином нуклид обозначают атом с определённым порядковым номером Z и массовым числом А, т.е. с определённым набором протонов и нейтронов. Нуклиды с одним и тем же атомным номером, но с разными массовыми числами называются изотопными нуклидами или просто изотопами (от греч. «изос» – «равный» и «топос» – «место»).
Другими словами, в ядрах всех изотопов данного элемента содержится одинаковое число протонов, но разное число нейтронов. Нуклиды обозначают символом элемента и массовым
- числом: 12С, 14N, 16O
- другая форма записи: углерод-12, азот-14, кислород-16
Если массовое число не указывать, то подразумеваются все природные изотопы данного элемента. Иногда указывают и атомный номер элемента, но это не обязательно, поскольку символ элемента однозначно связан с определённым Z.
Так, для атомов водорода Z = 1, для азота Z = 7, для кислорода Z = 8 и т.д. Разных нуклидов значительно больше, чем элементов. Например, в природе найдены три изотопа водорода – нуклиды 1Н, 2Н (другое обозначение D – дейтерий) и 3Н (или Т – тритий), три изотопа углерода (12С, 13С и 14С), четыре – серы, пять – кальция, шесть – селена, семь – молибдена, восемь – кадмия, девять – ксенона и десять – олова (это рекорд).
Есть и элементы одиночки, представленные всего одним нуклидом: 9Ве, 19F, 23Na, 27Al, 31P и др. Некоторые природные нуклиды нестабильны: со временем они распадаются; это – радионуклиды.
Ионы
В отличие от атомов, ионы – это заряженные частицы. Ионы образуются в том случае, если нейтральный атом «потеряет» или «приобретет» часть электронов. Например, в результате некоторой реакции, атом натрия утратил один электрон. Обратимся к Периодической Системе, согласно которой узнаем, что в атоме натрия 11 электронов. Если один электрон покинет атом, их останется 10, тогда нарушится принцип электронейтральности атома и положительно заряженное ядро будет доминировать, то есть частица приобретет положительный заряд. Частица Na+ и есть ион. Возможен и другой вариант, атом, в результате химической реакции, может присоединять электроны. В этом случае образуется избыток электронов и, следовательно, суммарный отрицательный заряд электронов больше, чем положительный заряд ядра. Такой ион будет заряжен отрицательно.
Молекулы
Из курса природоведения вам известно, что молекулы образуются из атомов посредством их взаимодействия в результате химических реакций. Например, молекула водорода Н2, образуется при взаимодействии двух атомов водорода. Молекула – наименьшая частица вещества, обладающая его химическими свойствами, состоящая из двух или более атомов Подобно молекулам водорода образуются и другие молекулы, например: молекула азота N2, кислорода О2, хлора Cl2 и другие молекулы. Конечно же, существуют и более сложные молекулы, состоящие из большего числа атомов. Например, сладкий вкус фруктам придает глюкоза. Существуют очень большие молекулы, в состав которых входят десятки, сотни и даже тысячи атомов! Например, молекулы белков, из которых состоят все живые организмы, состоят из сотен и тысяч различных атомов!
Атомно-молекулярная теория
Процесс познания складывается таким образом, что блестящие догадки и великие теории, являвшиеся в свое время результатом гениального творчества, через более или менее продолжительное время становятся едва ли не тривиальными фактами, которые большинство людей принимает на веру. Многие ли из нас могли бы самостоятельно, на основе наблюдений и размышлений, догадаться, что Земля круглая, или что Земля вращается вокруг Солнца, а не наоборот, и наконец, что существуют атомы и молекулы? С высоты современной науки основные положения атомно-молекулярной теории выглядят всем известными положениями.
Но для ученых прошлого, пытавшихся решить два основных вопроса:
- Из чего состоят вещества?
- Почему вещества бывают разными, и почему одни вещества могут превращаться в другие? на решение их ушло более 2000 лет.
Результатом стала атомно- молекулярная теория, основные положения которой можно сформулировать следующим образом:
- Все вещества состоят из молекул. Молекула – наименьшая частица вещества, обладающая его химическими свойствами.
- Молекулы состоят из атомов. Атом – наименьшая частица элемента в химических соединениях. Разным элементам соответствуют разные атомы.
- Молекулы и атомы находятся в непрерывном движении.
- При химических реакциях молекулы одних веществ превращаются в молекулы других веществ. Атомы при химических реакциях не изменяются.
Вывод из статьи про Атомы, ионы, молекулы
- Атом – мельчайшая частица вещества, состоящая из ядра и электронов, движущихся в околоядерном пространстве
- Атом состоит из элементарных частиц: электронов, протонов, нейтроно
- Заряд ядра определяется количеством протонов, и всегда имеет знак +. Заряд ядра обозначают символом Z (протонное число)
- Количество электронов и протонов в атоме химического элемента совпадает с его порядковым номером Z
- Округленная до целочисленного значения относительная атомная масса элемента называется массовым (нуклонным) числом и обозначается А
- Ион – заряженная частица, образовавшаяся в результате потери или присоединения атомом части электронов
- Катионы – ионы, заряженные положительно
- Анионы – ионы, заряженные отрицательно
- Молекула – нейтральная частица, состоящая из двух или более атомов
- Атомно-молекулярная теория является результатом развития представлений человека об окружающем мире
Атом. Ион
Текст является частью пособия по химии.
Автор текста – Анисимова Елена Сергеевна. https://vk.com/bch_5
Авторские права защищены. При копировании и передаче текста указание автора и ссылка на ВК обязательны.
Распространение и изучение текста приветствуется. – Давайте станем более информированными.
Курсивом набран текст пояснений, напоминаний или фактов на будущее. При первом чтении или спешке его можно не читать.
Справа расположены рекомендации.
Параграф 1: Элементарные частицы
Параграф 2: Атом
Параграф 3: Ионы
Параграф 1: Элементарные частицы
В природе есть вещицы, которые называют:
протонами, электронами и нейтронами.
Эти частицы относятся к элементарным частицам.
Эти три – основные, но есть и множество других.
Элементарные частицы очень маленькие по размерам, он не видны в микроскопы.
Масса элементарных частиц
Кратко: масса протона и нейтрона – по 1, масса электрона почти ноль.
Масса протона равна условной единице.
(См. определение атомной единицы массы).
Масса нейтрона почти равна массе протона, то есть тоже единице.
Масса электрона не ноль, но в 1836 раз меньше протона, и часто не учитывается.
Оформим эти сведения в виде маленькой таблицы для упрощения усвоения:
Протон Нейтрон Электрон
Масса 1 1 Почти 0
Заряды элементарных частиц (электрические заряды)
Кратко: заряд нейтрона – ноль, протона – плюс 1, электрона – минус 1.
Что такое электрический заряд?
Существует такое свойство тел, которое называют электрическим зарядом.
Наличие электрического заряда проявляется в способности реагировать на другие предметы, имеющие электрический заряд.
Реакция (заряженного тела на заряд другого) проявляется в том, что предмет, имеющий электрический заряд,
— или притягивается к другому заряженному предмету,
— или отталкивается от него.
Типы эл. зарядов.
Заряд бывает двух типов – один тип эл. заряда назван положительным, а другой тип – отрицательным.
Принято говорить, что положительный и отрицательный – разноимённые.
Положительный заряд притягивается к отрицательному (то есть разноимённые заряды притягиваются). Точнее, тела с такими зарядами.
Положительный от положительного отталкивается, отрицательный от отрицательного тоже отталкивается.
(То есть одноимённые отталкиваются – точнее, тела с одноимёнными зарядами).
Заряд нейтрона
У нейтрона нет электрического заряда, то есть он электронейтрален (отсюда и его название – нейтрон). То есть нейтрон не реагирует на частицы с эл. зарядом.
Заряды протона и нейтрона
У протона и электрона есть электрические заряды –
равные по величине, но противоположные по «знаку». –
Заряд протона считается положительным,
а заряд электрона считается отрицательным.
Величина заряда
Величина заряда протона или электрона принята за условную единицу.
Суммарный заряд протона и электрона равен нулю. (Сумма электро-нейтральна).
(Плюс один и минус один в сумме дают ноль.)
Когда число протонов равно числу электронов, то суммарный заряд равен нулю.
Если число протонов больше или меньше числа электронов – заряд не нулевой.
Таблицы «Заряды элементарных частиц»:
Протон Электрон Нейтрон
Заряд Плюс 1 Минус 1 0
Обобщение по свойствам элементарных частиц.
Таким образом, у нейтрона нет заряда, а у электрона почти нет массы.
Массы протона и нейтрона – по единице.
Заряды протона и электрона – по единице.
Свойства протона: масса 1 и заряд +1.
Свойства нейтрона: масса 1 и заряд 0.
Свойства электрона: масса 0 и заряд –1.
Обобщим сведения об основных свойствах элементарных частиц в таблице:
«Свойства элементарных частиц»
Протон Электрон Нейтрон
Масса 1 0 1
Заряд Плюс 1 Минус 1 Ноль
(нет заряда)
Это очень простые сведения.
Но из них есть множество важных выводов.
Из них выводится множество фактов. Так что эту таблицу – знать.
Элементарные частицы в природе
Потоки протонов и электронов распространяются от Солнца по всей Солнечной системе!
В каком виде существуют элементарные частицы в природе?
В «свободном виде» протоны и электроны есть в Солнце и многих других звёздах.
От Солнца протоны и электроны распространяются прочь от Солнца – по Солнечной системе. Этот поток заряженных частиц называют солнечным ветром.
Солнечный ветер оказывает влияние на жизнь людей:
он может приводить к сбоям техники, электроники, связи!
А если бы не атмосфера (воздушная оболочка Земли), то солнечный ветер мог бы погубить живые организмы Земли!
Но на Земле протоны, электроны и нейтроны обычно объединяются,
образуя системы: а-то-мы. (См. также ионы).
В космосе атомы тоже есть – в молекулярных облаках между звёздами.
Параграф 2: Атом
Протоны, электроны и нейтроны существуют в природе обычно не по отдельности,
а объединяются в единые системы.
Часто система из элементарных частиц содержит одинаковое число протонов и электронов.
Такая система из равного числа протонов и электронов называется атомом.
Атом тоже считается частицей, но уже не элементарной.
Атом – ключевое понятие в науках о веществах.
Часто в атоме есть и нейтроны. –
Иногда нейтронов в атоме столько же, сколько и протонов, иногда меньше (у протия), а иногда нейтронов намного больше, чем протонов; чем больше в атоме протонов – тем больше и нейтронов на долю протонов.
Протоны и электроны могут входить в состав единой системы,
которая называется атомом.
(Если протонов и электронов поровну).
Как уже сказано, число протонов и электронов в атоме всегда равное.
Из-за этого суммарный заряд протонов (он равен числу протонов со знаком плюс)
и суммарный заряд электронов (он равен числу электронов со знаком минус)
в сумме дают ноль – нейтральный заряд атома как целого или просто отсутствие заряда у атома.
Параграф 3: И-о-ны
Некоторые атомы могут присоединять к себе «лишние» электроны.
Некоторые атомы могут терять свои электроны (обычно от 1 до 7).
После потери электрона или присоединения электронов заряд атома перестаёт быть нулевым, и атом уже не атом!
Если атом теряет электрон или присоединяет к себе электрон, то он:
перестаёт быть нейтральным, перестаёт считаться атомом,
и получает название ИОН.
Ион не является нейтральной частицей.
Ион всегда имеет заряд, в отличие от атома.
Ион – это бывший атом; зарядившийся атом.
Атом плюс или минус электрон(ы) = ион
Но. Зарядившиеся молекулы тоже называют ионами – см. далее!
Какие бывают ионы…
Если атом теряет электроны (а вместе с ними и отрицательные заряды),
то в возникшем ионе:
имеется дефицит отрицательных зарядов (по сравнению с бывшим атомом),
что даёт иону положительный заряд.
Кратко: потеря электронов атомом превращает его в положительный ион (катион).
Атом минус электрон(ы) = ион с положительным зарядом (катион)
Если атом присоединяет к себе электроны (и отрицательный заряд вместе с ними),
то в возникшем ионе имеется избыток отрицательных зарядов.
Кратко: приобретение электронов атомом превращает его в отрицательный ион (анион).
Атом плюс электрон(ы) = ион с отрицательным зарядом (анион)
Явление превращения атома в ион (в результате присоединения электрона или потери электрона) называется ионизацией.
Где встречаются ионы
Ионы есть везде – на Земле, в воле, почве, воздухе, организме.
В Солнце в основном ионы, а атомов мало или нет, то есть вещество в ионизированном состоянии.
Типы атомов
Сколько бывает протонов в атомах?
Об этом – в файле «Типы атомов. Химические элементы».