Чем коллоидные растворы отличаются от истинных?
Разница между истинным раствором и коллоидным раствором
Раствор в химии — это жидкая смесь, содержащая два или более вещества. Некоторые решения являются бесцветными, а некоторые — красочными. Некоторые решения прозрачны, в то время как другие решения неп

Содержание:
- Основное отличие — настоящее решение против коллоидного раствора
- Что такое истинное решение
- Что такое коллоидный раствор
- Разница между истинным раствором и коллоидным раствором
Основное отличие — настоящее решение против коллоидного раствора
Раствор в химии — это жидкая смесь, содержащая два или более вещества. Некоторые решения являются бесцветными, а некоторые — красочными. Некоторые решения прозрачны, в то время как другие решения непрозрачны. Кроме того, в нашем окружении есть множество решений. Решения также можно разделить на три основные группы на основе фундаментальных различий. Эти три типа включают истинные растворы, коллоидные растворы и суспензии. главное отличие между истинным раствором и коллоидным раствором является то, что Истинные растворы являются гомогенными, тогда как коллоидные растворы являются гетерогенными. Гомогенные растворы показывают равномерное распределение частиц, тогда как гетерогенные растворы показывают неравномерное распределение.
Ключевые области покрыты
1. Что такое верное решение
— определение, свойства, примеры
2. Что такое коллоидный раствор
— определение, свойства, примеры
3. В чем разница между истинным раствором и коллоидным раствором
— Сравнение ключевых отличий
Ключевые слова: коллоидные растворы, гетерогенные растворы, гомогенные растворы, непрозрачные, растворы, прозрачные, настоящие растворы

Что такое истинное решение
Истинное решение — это смесь двух или более веществ. Эта смесь находится в жидкой фазе и является прозрачной. Это означает, что решение позволяет свету проходить через раствор, не рассеивая свет его частицами. Поэтому нет никаких частиц, которые видны невооруженным глазом.Было обнаружено, что размер частиц в истинном растворе составляет менее 1 нм. В большинстве случаев эти частицы не видны даже под мощными микроскопами.
Частицы настоящего раствора не фильтруются через мембранные фильтры или фильтровальную бумагу. Частицы настоящего раствора не оседают на дно контейнера. Истинные решения считаются однородными. Это означает, что количество частиц, присутствующих в единице объема раствора, везде в растворе одинаково. Поскольку размер частицы очень мал, плотность частиц (количество частиц, присутствующих в единице объема) очень высока.

Рисунок 01: Истинные решения прозрачны
Хорошим примером для истинных растворов является водный раствор сахара.
- Сахар в воде
Сахар является твердым материалом. Хорошо растворяется в воде. Когда сахар растворяется в воде, смесь сахара и воды является прозрачной, и молекулы сахара не могут быть получены путем фильтрации раствора.
Броуновский эффект можно наблюдать в истинных решениях. Броуновский эффект — это явление, которое описывает случайное движение частиц в жидкости из-за их столкновений.
Что такое коллоидный раствор
Коллоидный раствор представляет собой гетерогенную смесь двух или более веществ. Коллоидный раствор также находится в жидкой фазе. Частицы невидимы невооруженным глазом. Но эти частицы видны под мощными микроскопами. Размер частицы колеблется от 1 нм до 100 нм. Смесь представляет собой гетерогенную смесь, то есть распределение частиц не является равномерным по всему раствору.
Коллоидные растворы могут быть отфильтрованы через фильтровальную бумагу с небольшими отверстиями (например, пергаментная бумага). Частица коллоидного раствора не оседает на дно контейнера под действием силы тяжести. Но отстаивание может быть выполнено центрифугированием, который представляет собой метод получения растворенных частиц из раствора в виде шарика.

Рисунок 02: раствор желатина представляет собой коллоидный раствор
Коллоидные растворы являются полупрозрачными. Это означает, что коллоидный раствор пропускает свет через раствор, но свет рассеивается частицами раствора. Кроме того, броуновский эффект можно наблюдать в коллоидных растворах. Это означает, что частицы коллоидных растворов находятся в случайном движении из-за столкновений между ними. Желатин-водная смесь является хорошим примером для коллоидных растворов.
Разница между истинным раствором и коллоидным раствором
Определение
Истинное решение: Истинный раствор — это однородная жидкость, содержащая два или более вещества.
Коллоидный раствор: Коллоидный раствор представляет собой гетерогенную смесь двух или более веществ.
прозрачность
Истинное решение: Истинные решения прозрачны.
Коллоидный раствор: Коллоидные растворы являются полупрозрачными.
Размер частицы
Истинное решение: Размер частиц составляет 1 нм в истинных растворах.
Коллоидный раствор: Размер частиц составляет от 1 нм до 100 нм.
видимость
Истинное решение: Частицы истинного раствора невидимы невооруженным глазом и даже под мощными микроскопами.
Коллоидный раствор: Частицы коллоидного раствора невидимы невооруженным глазом, но видны под мощными микроскопами.
фильтрование
Истинное решение: Частицы настоящих растворов не могут быть отделены фильтрованием.
Коллоидный раствор: Частицы коллоидных растворов могут быть отделены от фильтрации через пергаментную бумагу.
оседание
Истинное решение: Частицы не оседают на дне контейнера в реальных растворах.
Коллоидный раствор: Частицы коллоидных растворов могут осесть на дне емкости путем центрифугирования.
Броуновский эффект
Истинное решение: Броуновский эффект не может наблюдаться в истинных решениях.
Коллоидный раствор: Броуновский эффект можно наблюдать в коллоидных растворах.
Заключение
Решения — это очень разнообразный тип материи. Они отличаются друг от друга своим внешним видом, природой, составом и т. Д. Однако все растворы находятся в жидкой фазе при нормальной температуре и давлении. Истинные растворы и коллоидные растворы представляют собой два основных типа растворов, которые отличаются друг от друга в зависимости от типа и природы частиц, которые они содержат. Основное различие между истинным раствором и коллоидным раствором состоит в том, что истинные растворы являются гомогенными, тогда как коллоидные растворы являются гетерогенными.
Рекомендации:
1. «Коллоидные растворы, суспензии и истинные растворы». Коллоидные растворы, суспензии и истинные растворы | TutorsOnNet. Н.п., н.д. Web.
Чем коллоидные растворы отличаются от истинных?

Дисперсные растворы — это системы, в которой фаза представлена частицами размером от 1 нм до 10 мкм. Дисперсные системы распространены, используются в промышленности. К ним относят: аэрозоли (капли или твердые частицы взвешены в воздухе), эмульсии (капли жидкости растворены в другой по природе жидкости), коллоидные растворы — являются золями (двухфазные гетерогенные системы, размер частиц которых находится в промежутке между эмульсиями и истинными растворами, то есть в пределах от 1 до 100 нм. Дисперсные частицы могут находиться в разнообразном агрегатном состоянии. Ансамбль частиц является фазой, а их совокупность — дисперсная среда (жидкие, газообразные и твердые).
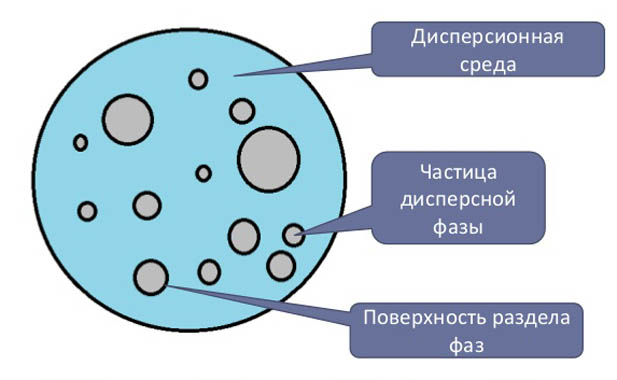
Состав дисперсной системы
Свойства и применение коллоидных растворов
В широком смысле, в сущности, коллоиды это все природные организмы и растения окружающей среды, преобладающую часть которых мы принимаем с пищей в коллоидном состоянии. К коллоидам также относят медикаменты, некоторые краски и даже строительные материалы (вяжущие растворы цемент и бетон, лакокрасочные и керамические материалы, горючие материалы, искусственные волокна, пластмассы).
Кинетические свойства гетерогенных дисперсных систем. Движение обусловлено различием размера частиц. Тонкая суспензия способна к броуновскому беспорядочному движению. К примеру, жир, добавленный в воду или молоко разбавленный водой. Движение частиц коллоидного раствора является термодинамические энергоемким.

Другим кинетическим свойством растворов является диффузия: процесс движения частиц вследствие различия их концентраций. Но твердые грубодисперсные частицы не участвуют в хаотичном движении, однако основная причина их движения — это разделение плотности фаз в дисперсной среде. Поэтому если плотность больше, то частицы постепенно оседают под действием сил тяжести — процесс седиментацией. Весьма распространенный процесс, используемый в молекулярной химии белков, нуклеиновых молекул и даже бактерий. Осмотическое давление коллоидов очень мало, так как коллоид обладает большой массой.

Оптические свойства раствора обусловлены способностью рассеивать свет, то есть наличие явления опалесценции (из-за оптической неоднородности). Наблюдается, если пропускать пучок света через кюветку, поставив перед собой линзу, тогда со стороны виден эффект (конус Тиндаля). Обусловлено это зависимостью размером частицы раствора и длины светового пучка.
Истинные растворы и их свойства
Истинные растворы — это прозрачные, однородные растворы с прочной дисперсной фазой, частицы размером меньше чем один нанометр, поэтому граница разделения фазы в растворе исчезает. Истинные растворы подразделяются на ионные, если дисперсная фаза состоит из гидратированных ионов (раствор натрий хлора, либо молекулярные (раствор глюкозы). Для человека незаменимую часть жизни играет вода, потому как в ней растворены все ионы организма, благодаря ней в организме происходят все обменные процессы между клетками.

Отличия между коллоидами и истинными растворами
Во-первых, истинные растворы прозрачные и гомогенные, частицы в дисперсной фазе меньше нанометра. Для них не характерна дифракция или опалесценция, нет конуса Тиндаля, то есть частицы настолько малы, что даже не видимы в ультрамикроскоп. При фильтрации коллоидные растворы через бумажные фильтры не проходят, а истинные фильтруются с легкостью, что показывает отличия между размером частиц дисперсной фазы. Истинные растворы проходят через клеточные мембраны. Термодинамичны и не устойчивы, расслаиваются, что характерно для коллоидных р-ров, а истинные — не расслаиваются.
Истинные растворы могу образовываться самопроизвольно, без затраты дополнительной энергии, а коллоидный раствор наоборот, то есть энергетический баланс для них не устойчив. Силы преобразования между фазой и средой для истинных растворов довольно велики, поэтому им не требуется стабилизатор. Механические свойства растворов отличны друг от друга. Истинные растворы более прочны, так как дисперсная фаза неподвижна, образует структуру внутри которой заключена среда (к примеру, костная ткань). Коллоидный раствор свободнодисперсные, обладает текучестью, поэтому концентрация фазы и среды равномерно распределены (пыль, дым либо туман).
Х и м и я

















Коллоидная химия
Растворы.
Растворами называют однородные системы переменного состава. Химический состав и физические свойства одного раствора во всех частях его объёма одинаковы.
В отличие от простого смешивания веществ, при растворении происходит взаимодействие между частицами, образующими раствор.
Часто для определения раствора используют понятия гомогенной и системы.
В этом случае, раствором называется гомогенная система, состоящая из двух или более компонентов.
Гомогенные и гетерогенные системы
Гомогенная система (от греч. όμός — равный, одинаковый; γένω — рождать) — однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела).
В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем.
Гетерогенная система (от греч. έτερος — разный; γένω — рождать) — неоднородная система, состоящая из однородных частей (фаз), разделённых поверхностью раздела.
Растворы могут существовать в трёх агрегатных состояниях – твёрдом, жидком и газообразном (парообразном). Примерами твёрдых растворов могут служить некоторые сплавы металлов, например сплав золота и меди, газообразных – воздух.
Наиболее важный вид растворов – жидкие растворы.
Растворы имеют чрезвычайно важное значение в жизни человека. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т.д.).
Растворители
Всякий раствор состоит из растворённых веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул и ионов.
Обычно растворителем считают тот компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор. Например, в случае водного раствора соли растворителем является вода.
Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
Истинные и коллоидные растворы
В растворах вещества могут находиться в различных степенях дисперсности (т.е. раздробленности). Величина частиц служит важным признаком, обуславливающим многие физикохимические свойства растворов.
По величине частиц растворы делятся на:
1. Истинные растворы (размер частиц меньше 1 мкм) и
2. Коллоидные растворы (размер частиц от 1 до 100 мкм).
Смеси с частицами размером более 100 мкм образуют взвеси: суспензии и эмульсии.
Истинные растворы могут быть ионными или молекулярными в зависимости от того, диссоциирует ли растворённое вещество на ионы или остаётся в недиссоциированном состоянии в виде молекул.
Коллоидные растворы резко отличаются по свойствам от истинных растворов. Они гетерогенны, так как имеют поверхность раздела между фазами – растворённым веществом (дисперсной фазой) и растворителем (дисперсионной средой).
Растворы высокомолекулярных соединений: белков, полисахаридов, каучука обладают свойствами как истинных, так и коллоидных растворов и выделяются в особую группу.
Растворы, механические смеси и химические соединения
Однородность растворов делает их очень сходными с химическими соединениями.
Химическое соединение — сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов.
Раствор это не одно химическое соединение, а как минимум два смешанных соединения. В отличие от простого смешивания веществ, при растворении происходит взаимодействие между частицами, образующими раствор.
Выделение теплоты при растворении некоторых веществ тоже указывает на химическое взаимодействие между растворителем и растворяемым веществом.
Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения.
Непостоянство состава растворов приближает их к механическим смесям.
Механическая смесь — физико-химическая система, в состав которой входят два или несколько химических соединений (компонентов). В смеси исходные вещества включены неизменными. При смешивании не возникает никакое новое вещество.
От механических смесей растворы резко отличаются своею однородностью. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями.
Процесс растворения
Растворение кристалла в жидкости протекает следующим образом.
Когда вносят кристалл в жидкость, в которой он может растворяться, от поверхности его отрываются отдельные молекулы. Последние благодаря диффузии равномерно распределяются по всему объёму растворителя.

Отделение молекул от поверхности твёрдого тела вызывается, с одной стороны, их собственным колебательным движением, а сдругой – притяжением со стороны молекул растворителя.
Этот процесс должен был бы продолжаться до полного до полного растворения любого количества кристаллов, если бы не происходил обратный процесс – кристаллизация. Перешедшие в раствор молекулы, ударяясь о поверхность ещё не растворившегося вещества, снова притягиваются к нему и входят в состав его кристаллов.
Понятно, что выделение молекул из раствора будет идти тем быстрее, чем больше концентрация раствора. А так как последняя по мере растворения вещества увеличивается, то, наконец наступает такой момент, когда скорость растворения становится равной скорости кристаллизации. Тогда устанавливается динамическое равновесие, при котором в единицу времени растворяется и кристаллизуется одинаковое число молекул.

Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором.
Концентрация растворов
Насыщенными растворами приходится пользоваться сравнительно редко. В большинстве случаев употребляются растворы ненасыщенные, т.е. с меньшей концентрацией растворённого вещества, чем в насыщенном растворе.
Концентрацией раствора называется количество растворённого вещества, содержащееся в определённом количестве раствора или растворителя.
Растворы с большой концентрацией растворённого вещества называются концентрированными, с малой – разбавленными.
Концентрацию раствора можно выражать по разному:
1. В процентах растворённого вещества по отношению ко всему количеству раствора.
2. Числом грам-молекул растворённого вещества, содержащегося в 1 литре раствора.
3. Числом грамм-молекул растворённого вещества, содержащегося в 1000 г растворителя и т.д.
Растворимость
Растворимостью называется способность вещества растворяться в том или ином растворителе.
Мерой растворимости вещества при данных условиях служит концентрация его насыщенного раствора.
Растворимость различных веществ колеблется в широких пределах.
- Если в 100 граммах воды растворяется более 10 г вещества, то такое вещество принято называть хорошо растворимым.
- Если растворяется менее 1 г вещества – малорастворимым.
- Если в раствор переходит менее 0,01 г вещества, то такое вещество называют практически нерастворимым.
Принципы, позволяющие предсказать растворимость вещества, пока не известны. Однако, обычно вещества, состоящие из полярных молекул, и вещества с ионным типам связи лучше растворяются в полярных растворителях (вода, спиры, жидкий амиак), а неполярные вещества – в неполярных растворителях (бензол, сероуглерод).
Растворение большинства твёрдых тел сопровождается поглощением теплоты. Это объясняется затратой значительного количества энергии на разрушение кристаллической решётки твёрдого тела, что обычно не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольватов).
Как правило, повышение температуры должно приводить к увеличению растворимости твёрдых тел.
Коллоидный раствор

Раство́р — гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии химического равновесия
Содержание
Твердые, жидкие, газообразные растворы
Чаще под раствором подразумевается жидкое вещество, например раствор соли или спирта в воде (или даже раствор золота в ртути — амальгама).
Существуют также растворы газов в жидкостях, газов в газах и жидкостей в жидкостях, в последнем случае растворителем считается вода, или же компонент, которого больше.
В химической практике обычно под растворами понимают гомогенные системы, растворитель может быть жидким, твердым (твёрдый раствор), газообразным. Однако нередко допускается и микрогетерогенность — см. «Золи».
Раствором именуют и смесь цемента с водой, песком и т.д. Хотя это и не является раствором в химическом смысле этого слова.
Истинные и коллоидные растворы
Коллоидные и истинные растворы (изучением коллоидных систем занимается коллоидная химия) отличаются главным образом размерами частиц.
В истинных растворах размер частиц менее 1·10 −9 м, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1·10 −9 м — 5·10 −7 м, частицы в таких растворах можно обнаружить при помощи ультрамикроскопа (см. эффект Тиндаля).
Растворение
Растворение — переход молекул вещества из одной фазы в другую ( раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда — цвет, и другие) меняются.
В случае химического взаимодействия растворителя и растворенного вещества сильно меняются и химические свойства — например, при растворении газа хлороводорода в воде образуется жидкая соляная кислота.
См. также
- Концентрированный раствор
- Разбавленный раствор
- Насыщенный раствор
- Ненасыщенный раствор
- Пересыщенный раствор
- Растворимость
Растворы электролитов и неэлектролитов
Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов).
См. также
Растворы полимеров
Растворы высокомолекулярных веществ ВМС — белков, углеводов и др. обладают одновременно многими свойствами истинных и коллоидных растворов. Средняя молекулярная масса растворенного
Концентрация растворов
В зависимости от цели для выражения концентрации растворов используются разные единицы измерения — весовой и объёмный процент, молярность, моляльность, г/л, мольная доля и др.
Мнемонические правила
В случаях приготовления растворов сильных кислот согласно правилам техники безопасности кислоту нужно лить в воду, но ни в коем случае не наоборот. Для запоминания этого лабораторного приема существует несколько мнемонических правил:
Сначала вода,
Потом кислота,
Иначе случится
Большая беда
- Не плюй в кислоту!
- Чай с лимоном (здесь нужно представить, как в чай Вы кладете дольку лимона).
См. также
- Эмульсия
- Суспензия
- Гель
- Золь
- Нанодисперсия
- Эвтектика
Wikimedia Foundation . 2010 .
- Коллоидное серебро
- Коллоксилин
Смотреть что такое «Коллоидный раствор» в других словарях:
коллоидный раствор — коллоидная дисперсия золь — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом Синонимы коллоидная дисперсиязоль EN colloidal solution … Справочник технического переводчика
коллоидный раствор — Colloid Solution Коллоидный раствор Раствор, размер частиц которого составляет от 10 9 до 5х10 7 м (1 500 нм). Отличается от истинного раствора (размер частиц менее 10 9 м), как правило, непрозрачен. Выделяют коллоидные растворы газа в… … Толковый англо-русский словарь по нанотехнологии. — М.
коллоидный раствор — koloidinis tirpalas statusas T sritis fizika atitikmenys: angl. colloidal solution vok. kolloide Lösung, f rus. коллоидальный раствор, m; коллоидный раствор, m pranc. solution colloïdale, f … Fizikos terminų žodynas
коллоидный раствор — Термин коллоидный раствор Термин на английском colloidal solution Синонимы дисперсная система, золь, colloidal system Аббревиатуры Связанные термины двойной электрический слой, диализ, золь, коагуляция, коллоидная химия, кристаллоид, критическая… … Энциклопедический словарь нанотехнологий
коллоидный раствор — koloidinis tirpalas statusas T sritis chemija apibrėžtis Koloidinė sistema, kurios disperguojančioji terpė – skystis. atitikmenys: angl. colloidal solution rus. коллоидный раствор … Chemijos terminų aiškinamasis žodynas
коллоидный раствор — коллоид … Cловарь химических синонимов I
КОЛЛОИДНЫЙ РАСТВОР КРЕМНЕЗЕМА — коллоидный кремнезем, кремнезоль высокодисперсный SiO2 (5 15 нм), стабилизированные в воде соединения щелочных металлов. Содержание SiO2 15 50%; плотность 1088 1202 кг/м3; рН при 20° С 9,5 10,6; удельная поверхность частиц SiO2 … Металлургический словарь
коллоидный раствор битума — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN Lamco Hydroproof … Справочник технического переводчика
КОЛЛОИДНЫЙ — КОЛЛОИДНЫЙ, коллоидная, коллоидное (хим.). прил. к коллоид. Коллоидный раствор. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
Коллоиднные растворы

Коллоиднные растворы
Раствор — однородная смесь , состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия.
Они делятся на истинные и коллоидные.
1. Истинные и коллоидные растворы
Коллоидные и истинные растворы отличаются главным образом размерами частиц.
Истинный раствор – это разновидность растворов, в которых размеры частиц растворенного вещества предельно малы и сопоставимы с размерами частиц растворителя.
В истинных растворах размер частиц менее 1·10−9 м. Частицы в таких растворах невозможно обнаружить оптическими методами
Коллоидные растворы — это растворы веществ с очень большими молекулами, либо такие, где растворенное вещество образует скопления молекул.
В коллоидных растворах размер частиц 1·10−9 м — 5·10−7 м, частицы в таких растворах можно обнаружить при помощи ультрамикроскопа.

Изучением коллоидов занимается коллоидная химия.
Колло́идная хи́мия — наука о дисперсных системах и поверхностных явлениях. представляет собой одну из важнейших и самостоятельных частей физической химии и включает в себя два основных раздела: физическую химию поверхностных явлений и физическую химию дисперсных систем .
Немного из истории коллоидной химии:
Как самостоятельная наука « Коллоидная химия » оформилась с выходом собственного печатного издания «Коллоидцайтшрифт», основанного немецким ученым в 1906 г. в г. Лейпциге, где он работал профессором Лейпцигского университета и одновременно директором основанного им Физико-химического института. К моменту выхода первого номера коллоидного журнала термин « коллоид » уже прочно вошел в обиход химиков. Этот термин ввел английский ученый Томас Грэм в 1861 г..
Характеристика коллоидных растворов
10–9 – 10–7 м
Скопления частиц
Взвешенные частицы проходят сквозь бумажный фильтр, но не проходят сквозь пергаментный фильтр
Относительно устойчивы во времени, со временем стареют с образованием осадка
2. Значение в природе
Ø Коллоидные растворы являются основными компонентами живых организмов, в том числе человека.
Ø Из коллоидов, богатых белками, состоят кожа, мышцы, ногти, волосы, кровеносные сосуды, лёгкие, весь желудочно-кишечный тракт и многое другое, без чего немыслима сама жизнь.
Ø Кровь — это дисперсная система, в которой ферментные элементы — эритроциты, тромбоциты, лейкоциты — являются частицами, а плазма — дисперсной средой.
Ø В науке существует отдельное направление – коллоидно-химическая физиология человека, — изучающее функционирование систем организма, образующих коллоидные соединения.
Ø Можно смело сказать, что человек — это коллоидный организм; даже наши кости являются коллоидом, насыщенным кальцием и фосфором.
Ø Мельчайшей структурно-функциональной единицей организма является клетка. Она тоже представляет собой сложный комплекс коллоидных образований, основными из которых являются клеточные мембраны, цитоплазма, ядро и др. Каждая клетка окружена клеточной стенкой, или мембраной. Коллоидные свойства мембран обеспечивают обменные функции, проникновение питательных веществ в клетку и выведение из неё продуктов метаболизма, а также множество других важнейших функций, обеспечивающих жизнеспособность клеток и нормальное протекание биохимических процессов.
Ø Сохранение коллоидности мембран необходимо как для самой клетки, так и для нормального функционирования мембранных клеточных структур, например «энергетических станций» клеток митохондрий. Ядро клетки — структура, в которой хранится генетическая информация в виде молекул ДНК. Коллоидная среда ядра обеспечивает нормальные условия сохранения генетической информации.
Необычайно важную роль коллоидные растворы играют в геологических и бионеорганических системах, в том числе в «жизни» минералов и почв.
3. Проделанные опыты по получению коллоидов и результаты исследований.
В ходе проекта мы провели лабораторную работу по получению коллоидных растворов.
1 крахмальный клейстер
2 насыщенный раствор серы в этаноле
3 гидролиз хлорида железа( III )
4 коллоид кремниевой кислоты
5 берлинская лазурь
*реакции должны быть выведены на экран*
В результате опытов были получены коллоиды.
Направляя лучи света в каждый из них, мы наблюдали эффект Тиндаля.
Об этом эффекте мы расскажем немного позже.
4.Диализ крови:
Ø Диализ — освобождение коллоидных растворов и субстанций высокомолекулярных веществ от растворённых в них низкомолекулярных соединений при помощи полупроницаемой мембраны . При диализе молекулы растворенного низкомолекулярного вещества проходят через мембрану, а неспособные диализировать (проходить через мембрану) коллоидные частицы остаются за ней.
Ø В медицине существует метод очищения крови, который называется диализ крови или гемодиализ.
Ø Гемодиализ — метод внепочечного очищения крови при острой и хронической почечной недостаточности . Во время гемодиализа происходит удаление из организма токсических продуктов обмена веществ, нормализация нарушений водного и электролитного балансов.
Ø Эта процедура жизненно необходима людям, еще не нашедшим донорскую почку.
5. Эффект Тиндаля
Эффект Тиндаля , рассеяние Тиндаля — оптический эффект, рассеяние света при прохождении светового пучка через оптически неоднородную среду. Обычно наблюдается в виде светящегося конуса, видимого на тёмном фоне.
Он характерен для растворов коллоидных систем, в которых частицы и окружающая их среда различаются по показателю преломления. На эффекте Тиндаля основан ряд оптических методов определения размеров, формы и концентрации коллоидных частиц и макромолекул.
Эффект Тиндаля назван по имени открывшего его Джона Тиндаля .
6.Коллоидные растворы имеют свойство «стареть».
Ø Стар е ние колл о идов — самопроизвольное медленное изменение свойств коллоидных систем . Старение коллоидов проявляется, например, в укрупнении частиц дисперсной фазы ( коагуляция ), седиментации , застудневании , рекристаллизации и др.
Ø Как было сказано ранее, человеческие клетки являются коллоидами. Это объясняет старение кожи.
7. Применение в промышленности и жизни
Коллоидными растворами являются клеи и краски. Иногда в коллоидных растворах происходит слипание частиц (коагуляция), при этом образуются гели – студенистые вещества. Примером геля могут служить фотографическая эмульсия, применяемая для изготовления фотопленок и фотобумаг, а также такие продукты, как студень, мармелад.
Всевозможные коллоидные системы, преимущественно аэрозоли, нашли применение в промышленности.
В таких отраслях, как мыловаренная, маргариновая, фармацевтическая, парфюмерная, производство пластмасс, искусственного волокна и многих других.
Коллоиды изготавливают специально, поскольку это сырьё, например для резиново-бумажной, кондитерской, текстильной промышленности.
В технике образование аэрозолей — процесс нежелательный, поскольку загрязняется атмосфера. Над промышленными центрами возникают сложные аэрозоли, когда огромные массы дыма смешиваются с атмосферным туманом и пылью.
При этом образуется смог. Загрязнение воздуха — актуальная экологическая проблема.
8. Подведение итогов и вывод
· Преимущества очевидны:
· Коллоидные растворы находят широкое применение в
· Промышленности (кондитерская, мыловаренная, маргариновая, фармацевтическая, парфюмерная, производство пластмасс, искусственного волокна)
Так же они входят в состав кожи, мышц, ногтей, волос, кровеносных сосудов, лёгких, желудочно-кишечного тракта, клеток и многого другого.
· Коллоиды – неотъемлемая часть живой и неживой природы.
Исходя из всего вышесказанного, можно с уверенностью сказать: коллоидные растворы — сама жизнь!


























